MORBUS KRABBE
Description
La forme infantile apparaît chez le nourrisson entre deux et six mois de vie, et est divisée en trois stades. Au cours du premier stade, les symptômes incluent une irritabilité, une raideur, un mauvais contrôle de la tête, des difficultés d'alimentation, des pouces pliés de manière intermittente, des épisodes d'hyperthermie et un retard de croissance. Au cours du second stade, des épisodes hypertoniques avec opisthotonos surviennent, et des crises myocloniques, une régression du développement, des difficultés à serrer le poing et des troubles de la vision sont observés. Au cours du troisième stade, une hypotonie, une cécité et une surdité apparaissent. Les patients évoluent vers un état végétatif et la maladie est fatale avant l'âge de 2-3 ans, généralement à cause d'infections respiratoires. Dans les formes à début tardif (1-8 ans) et adulte (>8 ans), les symptômes varient grandement et la progression est variable (elle est généralement plus lente chez les patients plus âgés). Les patients avec une forme à début tardif ressemblent plus aux patients ayant la forme infantile, tandis que les premiers signes des formes adultes sont généralement une faiblesse, des troubles de la démarche (paraparésie spastique ou ataxie), une paresthésie avec sensation de brûlure, une hémiplégie, et/ou une perte de la vision avec ou sans neuropathie périphérique. La régression des fonctions cognitives est variable et souvent absente dans les formes de l'adulte.
Etiologie
a maladie est due à des mutations du gène GALC (14q31) codant pour l'enzyme lysosomale galactocérébrosidase qui catabolise l'hydrolyse du galactose à partir du galactocérébroside et de la galactosylsphingosine (psychosine). L'accumulation de psychosine cytotoxique conduit à l'apoptose des oligodendrocytes et à la démyélinisation des SNC et SNP. De manière occasionnelle, la maladie infantile de Krabbe est causée par une mutation du gène de la prosaposine PSAP (10q21-q22) codant pour la saposine-A, protéine activatrice des sphingolipides, nécessaire pour l'activité de GALC.
Méthode(s) diagnostique(s)
Le diagnostic est suspecté devant le tableau clinique, la faible vitesse de conduction nerveuse, l'électroencéphalogramme anormal et l'IRM du cerveau révélant des anomalies de la substance blanche (démyélinisation, gliose, atrophie cérébrale dans le stade avancé, calcifications cérébrales). Le diagnostic est établi à partir de tests enzymatiques sur des leucocytes ou des fibroblastes en culture, révélant une déficience de GALC dans presque tous les cas. Au niveau histologique, des cellules globoïdes caractéristiques (souvent des cellules plurinucléées d'origine macrophagique contenant du galactocérébroside non hydrolysé) sont présentes dans la substance blanche. L'analyse de la mutation confirme le diagnostic.
Diagnostic(s) différentiel(s)
Le diagnostic différentiel inclut la leucodystrophie métachromatique, la gangliosidose à GM1, la gangliosidose à GM2, la maladie de Canavan, l'encéphalopathie due à un déficit en prosaposine, l'adrénoleucodystrophie liée à l'X, la maladie de Pelizaeus-Merzbacher et la maladie d'Alexander (voir ces termes).
Diagnostic prénatal
Le diagnostic prénatal (dépistage enzymatique ou analyse de la mutation) est possible pour les familles à risque. Si les mutations causant la maladie sont identifiées dans la famille, un dépistage génétique préimplantatoire est possible.
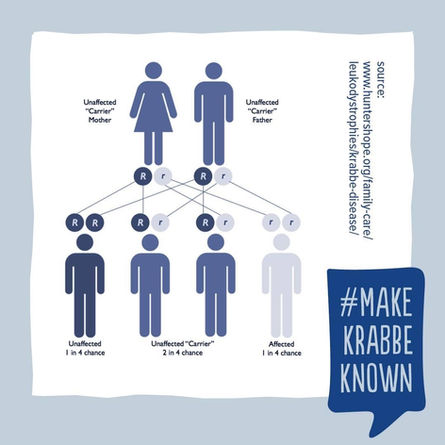
Conseil génétique
La maladie se transmet selon un mode autosomique récessif. Un conseil génétique doit être proposé aux couples à risque (les deux individus sont porteurs de la mutation), en les informant du risque de 25% de donner naissance à un enfant malade.
Prise en charge et traitement
Pour les patients ayant une forme infantile pré-symptomatique et une forme tardive légère, le traitement est limité à la transplantation des cellules souches hématopoïétiques, ce qui ralentit la progression de la maladie. D'autres options thérapeutiques (thérapie chaperon, thérapie de remplacement enzymatique, thérapie génique) sont actuellement à l'étude dans des modèles animaux.
Pronostic
Une dégénérescence neuronale et un décès précoce (<2-3 ans) surviennent dans la plupart des cas infantiles. Chez les patients avec forme à début tardif, la maladie est généralement fatale deux à sept ans après le début des symptômes. Les patients avec la forme adulte peuvent survivre plusieurs années après l'apparition des symptômes.